Nhiệt độ sôi của ankan là một khái niệm quan trọng trong lĩnh vực hóa học và vật lý. Được định nghĩa là nhiệt độ tối đa mà chất ankan có thể chuyển từ trạng thái lỏng sang trạng thái hơi ở áp suất xác định. Nó đóng vai trò quan trọng trong các quá trình chưng cất, làm việc với chất lỏng trong các hệ thống nhiệt độ cao, và còn có nhiều ứng dụng khác trong ngành công nghiệp và nghiên cứu.
Trong bài viết, chúng ta sẽ tìm hiểu về nhiệt độ sôi của ankan, cách đo và ảnh hưởng của áp suất lên quá trình sôi ,tính chất vật lý của chất này và ứng dụng của nó trong các lĩnh vực khác nhau. Hãy cùng hamhochoi.net khám phá nhé!
Nhiệt độ sôi của ankan như thế nào ?

Theo thứ tự dãy đồng đẵng (Ankan, Anken, Ankin, Aren, …), nhiệt độ sôi tăng dần vì khối lượng phân tử càng lớn. Ví dụ, so sánh giữa C2H6 và CH4, ta có:
C2H6 > CH4
Tương tự, khi xét các loại ankan, anken, ankin, aren, thứ tự nhiệt độ sôi như sau:
Ankan < Anken < Ankin < Aren
Lý do cho sự tăng nhiệt độ sôi là do tăng số lượng liên kết pi trong các phân tử. Mặc dù khối lượng phân tử có thể tương đương, nhưng với việc tăng số lượng liên kết pi, cần một lượng năng lượng lớn hơn để phá vỡ những liên kết này.
Đối với các đồng phân, đồng phân có mạch dài hơn sẽ có nhiệt độ sôi cao hơn. Điều này có liên quan đến lực phân tán London, một loại lực hút giữa các phân tử không có liên kết hóa học. Mạch carbon dài hơn tạo ra một diện tích tiếp xúc lớn hơn, từ đó tăng khả năng tương tác giữa các phân tử và làm tăng nhiệt độ sôi.
Đối với các dẫn xuất R-X (với X là một nguyên tử khác), nếu không có liên kết hidro, nhiệt độ sôi sẽ càng cao khi X có khả năng hút electron mạnh hơn. Điều này liên quan đến sự tác động của nhóm X lên tính chất hóa học của dẫn xuất, gồm cả tác động đến nhiệt độ sôi.
Các tính chất hóa học của Ankan:

Ở nhiệt độ thông thường, Ankan không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa. Tuy nhiên, khi được đun nóng hoặc chiếu sáng, Ankan có thể dễ dàng tham gia vào các loại phản ứng thế, phản ứng tách hidro và phản ứng cháy. Dưới đây là ba loại phản ứng điển hình của Ankan.
Phản ứng thế của Ankan bởi Halogen (Cl2, Br2):
Khi Ankan và Clo được chiếu sáng hoặc đốt nóng, xảy ra phản ứng thế liên tiếp của các nguyên tử Hiđro bằng Clo. Các phương trình hóa học tương ứng là:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH3Cl3 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
Nhận xét:
Các đồng đẳng của Metan cũng tham gia vào phản ứng thế tương tự như Metan.
Nguyên tử Hiđro liên kết với nguyên tử cacbon ở bậc cao hơn dễ bị thế hơn so với nguyên tử Hiđro liên kết với nguyên tử cacbon ở bậc thấp hơn.
Phản ứng thế Hiđro bằng Halogen thuộc loại phản ứng Halogen hóa, và sản phẩm hữu cơ chứa Halogen được gọi là dẫn xuất Halogen.
Khả năng phản ứng của dãy halogen là F2 > Cl2 > Br2 > I2.
Phản ứng Br hóa có khả năng phản ứng chậm hơn Cl hóa, nhưng có độ chọn lọc cao.
Xem thêm bài viết:
Giải thích phản ứng Cu + HNO3 loãng
Dung dịch kiềm là gì?tính chất và cách sử dụng dung dịch kiềm
Phản ứng tách của Ankan
Phản ứng tách H2 của Ankan, còn được gọi là phản ứng đề Hidro hóa.
Công thức tổng quát: CnH2n+2 → CnH2n + H2.
Chỉ các Ankan có ít nhất 2 nguyên tử C trong phân tử mới có khả năng tham gia phản ứng tách H2. Trong quá trình này, hai nguyên tử H được tách ra từ hai nguyên tử C kề nhau và tạo thành phân tử H2. Phản ứng đề Hidro hóa ưu tiên tách H từ các nguyên tử C có độ bậc cao.
Ví dụ: CH3-CH2-CH3 → CH2=CH-CH3 + H2.
Cần lưu ý một số trường hợp đặc biệt sau:
- CH3-CH2-CH2-CH3 → 2H2 + CH2=CH-CH=CH2.
- CH3-CH(CH3)-CH2-CH3 → CH2=C(CH3)-CH=CH2 + 2H2.
- n-C6H14 → 4H2 + C6H6 (Benzen).
- n-C7H16 → 4H2 + C6H5CH3 (Toluen).
- Phản ứng tách mạch cacbon của Ankan (n≥ 3) và phản ứng phân hủy của Ankan.
Phản ứng tách mạch cacbon của Ankan, còn được gọi là phản ứng Cracking, xảy ra trong điều kiện nhiệt độ, áp suất và xúc tác phù hợp. Công thức tổng quát của phản ứng này là: CnH2n+2 → CxH2x+2 + CyH2y. Đối với các Ankan thẳng CnH2n+2, quá trình Cracking có thể xảy ra theo (n – 2) hướng khác nhau, tạo ra 2(n-2) sản phẩm khác nhau. Số mol của Ankan sau phản ứng luôn bằng số mol của Ankan ban đầu, bất kể quá trình Cracking có nhiều giai đoạn hay không.
Phản ứng oxy hóa Ankan (Phản ứng cháy của Ankan)
Ankan có tính chất bền với tác nhân oxy hóa ở nhiệt độ thông thường. Tuy nhiên, ở nhiệt độ cao hoặc có mặt xúc tác, Ankan có thể phản ứng với oxi, KMnO4, K2Cr2O7 để tạo thành các chất như Ancol, Andehit, Xeton và Acid carboxylic.
Công thức tổng quát của phản ứng oxy hóa Ankan (phản ứng cháy) là:
2CnH2n+2 + (3n + 1)O2 → (nhiệt độ) 2nCO2 + (2n+2)H2O.
Trong phản ứng cháy của Ankan, cần lưu ý hai đặc điểm sau: nCO2 < nH2O và nH2O – nCO2 = nankan bị đốt cháy.
Nếu khi đốt cháy một hiđrocacbon, ta thu được nCO2 < nH2O, thì hiđrocacbon đó thuộc loại Ankan. Nếu đốt cháy một hỗn hợp hiđrocacbon và nCO2 < nH2O, thì trong hỗn hợp đốt cháy có chứa ít nhất một Ankan.
Sự ảnh hưởng của mạch carbon và đồng phân
Tác động của mạch carbon:
Mạch carbon là yếu tố quan trọng quyết định nhiệt độ sôi của các ankan. Đối với các ankan có cùng khối lượng phân tử, ankan có mạch carbon dài hơn sẽ có nhiệt độ sôi cao hơn. Điều này có liên quan đến lực phân tán London, một loại lực tương tác giữa các phân tử không phân cực. Các phân tử ankan có mạch carbon dài hơn có diện tích bề mặt tương tác lớn hơn, tạo ra lực phân tán London mạnh hơn và do đó có nhiệt độ sôi cao hơn.
Tác động của đồng phân:
Đồng phân là các phân tử có cùng công thức phân tử nhưng có cấu trúc khác nhau. Trong trường hợp các đồng phân ankan, đồng phân có mạch carbon dài hơn sẽ có nhiệt độ sôi cao hơn. Điều này liên quan đến cấu trúc và hình dạng của các đồng phân. Đồng phân với mạch carbon dài tạo ra một bề mặt tương tác lớn hơn và có khả năng tạo ra lực phân tán London mạnh hơn, dẫn đến nhiệt độ sôi cao hơn so với các đồng phân khác.
tác động của các dẫn xuất
Ngoài mạch carbon và đồng phân, các dẫn xuất cũng có thể ảnh hưởng đến nhiệt độ sôi của ankan. Đặc biệt, trong trường hợp dẫn xuất R-X, trong đó X đại diện cho một nguyên tử hoặc nhóm nguyên tử khác liên kết với carbon, nhiệt độ sôi sẽ phụ thuộc vào tính chất của nguyên tử hoặc nhóm nguyên tử này.
Nếu không có liên kết hidro giữa R và X, nhiệt độ sôi của ankan sẽ càng cao khi X hút e càng mạnh. Điều này liên quan đến khả năng tạo ra lực tương tác giữa phân tử ankan và X. Nếu X là một nguyên tử có độ âm điện cao, nó sẽ hút các electron từ mạch carbon của ankan và tạo ra một lực tương tác mạnh, làm tăng năng lượng cần thiết để phá vỡ liên kết trong quá trình sôi.
Ngoài ra, các dẫn xuất có thể ảnh hưởng đến cấu trúc và hình dạng của phân tử ankan, từ đó ảnh hưởng đến nhiệt độ sôi. Các nhóm chức có thể tạo ra hiệu ứng điện tử đặc biệt, làm thay đổi mật độ electron trong mạch carbon và ảnh hưởng đến sự tương tác giữa các phân tử ankan. Điều này có thể dẫn đến sự thay đổi nhiệt độ sôi của ankan trong dẫn xuất so với ankan gốc.
Ứng dụng của ankan
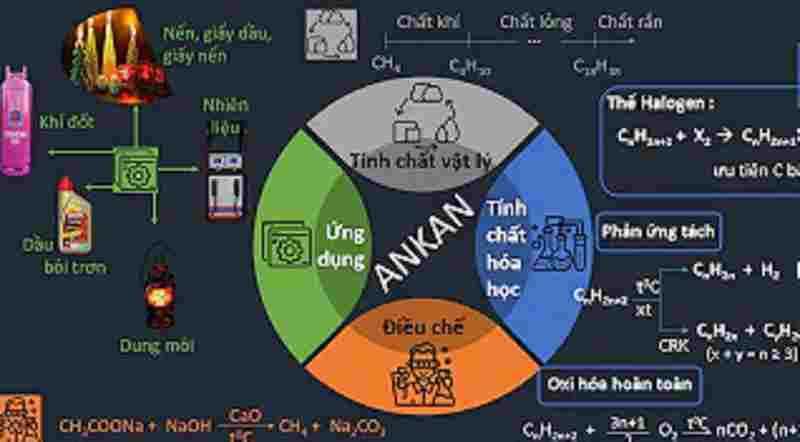
Dựa trên tính chất hóa học của ankan, nó được ứng dụng rất nhiều trong đời sống. Cụ thể:
– Ankan dùng làm nguyên liệu trong đèn xì để hàn, cắt kim loại.
– Làm dầu bôi mỡ bôi trơn, chống gỉ.
– Sáp pha thuốc mỡ và đun nấu
– Làm dung môi.
– Ứng dụng để tổng hợp nhiều chất hữu cơ khác như CH3Cl, CH2Cl2 , CCl4, CF2Cl2…
Nhiệt độ sôi của ankan có thể tăng dần theo số nguyên tử cacbon trong phân tử. Điều này cho thấy mối liên hệ giữa cấu trúc phân tử ankan và tính chất vật lý của chúng.Hi vọng những kiến thức trên mà chúng tôi đã chia sẻ trong bài viết này sẽ thật sự hữu ích và ý nghĩa đối với bạn.