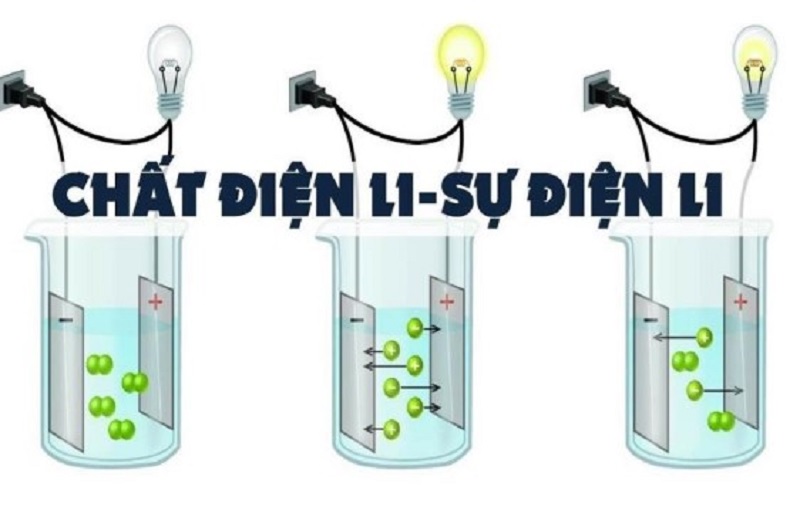
Để phân biệt được chất điện li có những chất gì chúng ta cần tìm hiểu về sự điện li là gì? chất điện li là gì? phân loại các chất điện li yếu điện li mạnh như thế nào? Bạn hãy tham khảo bài viết dưới đây của hamhochoi.net để hiểu rõ chi tiết hơn về các chất điện nhé!
Sự điện li là gì?
Sự điện li là quá trình phân ly các chất trong nước tạo thành ion âm và ion dương, là nguyên nhân khiến các dung dịch axit, bazo và muối có khả năng dẫn điện.
Ion dương được tạo thành khi nguyên tử hoặc phân tử nhận thêm điện tích dương bằng cách mất đi electron. Quá trình này xảy ra khi nguyên tử hoặc phân tử hấp thụ đủ năng lượng để giải phóng electron và tạo thành ion dương. Năng lượng cần thiết để diễn ra quá trình này được gọi là năng lượng ion hóa.
Ion âm được tạo thành khi một electron tự do chạm vào một nguyên tử trung hòa điện và bị giữ lại, thiết lập một hàng rào thế năng với nguyên tử đó. Ion âm không có đủ năng lượng để thoát khỏi nguyên tử này nữa, do đó nó tồn tại dưới dạng ion âm.
Trong trường hợp điện li đơn giản như NaCl, các liên kết ion trong chất được tách ra và tạo thành các ion riêng biệt trong môi trường nước. Các ion này có khả năng di chuyển tự do trong dung dịch và góp phần tạo nên khả năng dẫn điện của dung dịch..
Chất điện li là gì?
Chất điện li, chất điện giải hoặc chất điện phân là những chất có khả năng tan trong nước (hoặc nóng chảy) và phân li ra ion. Chúng bao gồm axit, bazo và muối.
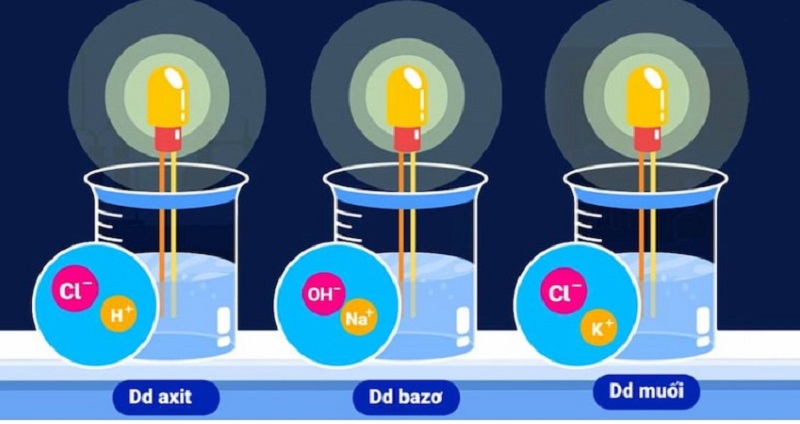
- Axit: Là chất có khả năng nhả proton (H+) khi tan trong nước, tạo thành ion hidro (H3O+) hay ion âm. Ví dụ: axit clohidric (HCl), axit nitric (HNO3), axit sulfuric (H2SO4)…
- Bazo: Là chất có khả năng nhả hydroxyl (OH-) khi tan trong nước, tạo thành ion hydroxyl hay ion dương. Ví dụ: hidroxit natri (NaOH), hidroxit kali (KOH), hidroxit nhôm (Al(OH)3)…
- Muối: Là chất có thành phần ion gồm cả cation và anion. Các ion này tạo thành từ việc phân li của muối trong nước. Ví dụ: clorua natri (NaCl), nitrat bạc (AgNO3), sulfat kẽm (ZnSO4)…
Các chất điện li khi tan trong nước tạo thành dung dịch có khả năng dẫn điện do sự tồn tại và di chuyển tự do của các ion dương và ion âm trong dung dịch.
Sự điện li của các chất điện li có thể được biểu diễn bằng phương trình điện li. Phương trình điện li cho thấy quá trình phân li của chất và các ion được tạo thành trong dung dịch. Ví dụ một số phương trình điện li đơn giản:
- Phương trình điện li cho quá trình phân li của muối natri clorua (NaCl): NaCl → Na+ + Cl-
- Phương trình điện li cho quá trình phân li của bazơ natri hidroxit (NaOH): NaOH → Na+ + OH-
- Phương trình điện li cho quá trình phân li của axit clohidric (HCl): HCl → H+ + Cl-
Phân loại các chất điện li yếu và điện li mạnh

Xem thêm bài viết:
Nhiệt độ sôi của ankan – Tính chất và ứng dụng
Giải thích phản ứng Cu + HNO3 loãng
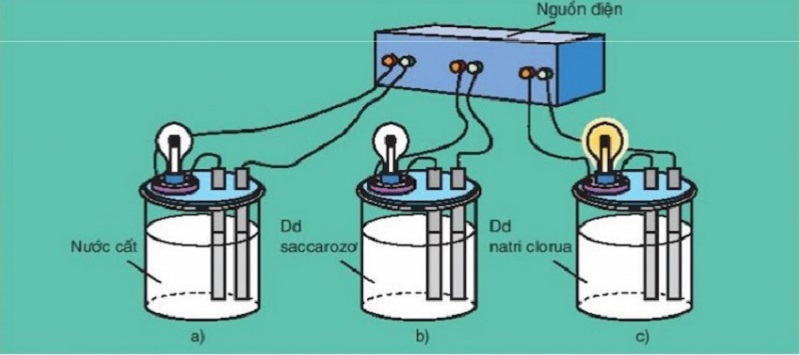
Để phân loại các chất điện li, người ta làm thí nghiệm sau.
Dựa trên sự dẫn điện của các dung dịch axit HCl và axit acetic CH3COOH để phân loại chúng thành chất điện li mạnh và chất điện li yếu.
Khi dẫn điện cùng một nguồn vào đầu dây dẫn được đặt trong hai dung dịch HCl và CH3COOH, bóng đèn ở phía dung dịch HCl sáng hơn bóng đèn phía dung dịch CH3COOH. Điều này cho thấy dung dịch HCl có khả năng dẫn điện tốt hơn và chứa nhiều ion hơn so với dung dịch CH3COOH.
Nguyên nhân là do khả năng phân li của các chất điện li trong dung dịch. Trong trường hợp axit HCl, nó phân li hoàn toàn thành các ion dương H+ và ion âm Cl-, tạo ra một nồng độ ion cao trong dung dịch. Trong khi đó, axit axetic CH3COOH chỉ phân li một phần nhỏ thành ion dương CH3COO- và một số ít ion H+, vì vậy dung dịch không chứa nồng độ ion cao như dung dịch axit HCl.
Dựa vào thí nghiệm trên, ta có thể kết luận rằng nồng độ ion trong dung dịch HCl lớn hơn nồng độ ion trong dung dịch CH3COOH. Điều này cho thấy số phân tử HCl phân li thành ion nhiều hơn số phân tử CH3COOH. Do đó, ta có thể xem HCl là một chất điện li mạnh vì nó phân li hoàn toàn thành ion, trong khi CH3COOH là một chất điện li yếu vì nó chỉ phân li một phần thành ion. Chất điện li được chia thành 2 loại là chất điện li mạnh và chất điện li yếu.
Chất điện li mạnh
Chất điện li mạnh là những chất có khả năng phân li hoàn toàn thành ion trong dung dịch. Khi tan trong nước, các phân tử của chất điện li mạnh sẽ phân li thành các ion dương và ion âm.
Chất điện li mạnh bao gồm: axit mạnh như axit hydrochloric (HCl), axit nitric (HNO3), axit sulfuric (H2SO4) và bazơ mạnh như hidroxit natri (NaOH), hidroxit kali (KOH), hidroxit bari (Ba(OH)2), hidroxit canxi (Ca(OH)2) và nhiều muối của axit mạnh và bazơ mạnh như clorua natri (NaCl), nitrat kali (KNO3), clorua kali (KCl), sunfat kali (K2SO4), và nhiều loại muối khác.
Trong phương trình điện li của chất điện li mạnh, ta sử dụng mũi tên một chiều để chỉ chiều của quá trình phân li, tức là chất điện li mạnh phân li thành ion và không có quá trình ngược trở lại.
Ví dụ: HCl (aq) → H+ (aq) + Cl- (aq) NaOH (aq) → Na+ (aq) + OH- (aq) NaCl (aq) → Na+ (aq) + Cl- (aq)
Lưu ý rằng không tất cả các chất điện li đều mạnh, một số chất điện li có khả năng phân li chỉ một phần thành ion, được gọi là chất điện li yếu.
Chất điện li yếu
Chất điện li yếu là những chất có khả năng phân li chỉ một phần số phân tử thành ion trong dung dịch. Phần còn lại của chất vẫn tồn tại dưới dạng phân tử trong dung dịch.
Chất điện li yếu bao gồm: axit yếu như axit axetic (CH3COOH), axit hypochlorous (HClO), axit sulfhydric (H2S), axit hydrazoic (HN3), axit sulfurous (H2SO3), và bazơ yếu như hidroxit bismuth (Bi(OH)3), hidroxit magiê (Mg(OH)2), và nhiều chất khác.
Trong phương trình điện li của chất điện li yếu, ta sử dụng mũi tên hai chiều để biểu thị quá trình phân li và quá trình tổ hợp. Điều này cho thấy chất điện li yếu phân li thành ion và cũng có khả năng tổ hợp lại thành phân tử.
Ví dụ: CH3COOH (aq) ⇌ CH3COO- (aq) + H+ (aq) Bi(OH)3 (aq) ⇌ Bi(OH)2+ (aq) + OH- (aq)
Lưu ý rằng chất điện li yếu có khả năng phân li chỉ phần nhỏ thành ion, do đó dung dịch của chúng có nồng độ ion thấp hơn so với chất điện li mạnh.
Phương trình điện li của chúng là là những phương trình phản ứng thuận nghịch.
Cân bằng điện li
Cân bằng điện li là một hệ cân bằng động và tuân theo nguyên tắc Le Chatelier. Theo nguyên lý này, cân bằng điện li sẽ dịch chuyển theo chiều ngược lại để chống lại bất kỳ thay đổi nào trong hệ thống.
Sự phân li của chất điện li sẽ càng hoàn toàn khi cân bằng dịch chuyển theo chiều thuận. Điều này có nghĩa là càng nhiệt độ cao hoặc dung dịch càng loãng, sự phân li sẽ càng hoàn toàn và cân bằng sẽ dịch chuyển theo chiều thuận. Do đó, để so sánh độ mạnh của các chất điện li ở cùng một điều kiện nhiệt độ và nồng độ, ta có thể xem xét mức độ phân li của chúng.
Chất điện li mạnh sẽ có mức độ phân li cao, tức là cân bằng điện li của chúng sẽ dịch chuyển theo chiều thuận. Ngược lại, chất điện li yếu sẽ có mức độ phân li thấp, cân bằng điện li của chúng sẽ dịch chuyển theo chiều nghịch.
Tuy nhiên, cần lưu ý rằng độ mạnh của một chất điện li không chỉ phụ thuộc vào nhiệt độ và nồng độ, mà còn phụ thuộc vào tính chất hóa học của chất đó. Một số chất điện li có thể mạnh ở nhiệt độ thấp và nồng độ cao, trong khi các chất khác có thể yếu ở cùng điều kiện đó.
Thông qua quan sát và so sánh độ phân li của các chất điện li, ta có thể đánh giá được mức độ mạnh yếu của chúng.
Bài viết đã cung cấp một cái nhìn tổng quan về sự điện li, chất điện li và phân loại các chất điện li. Hy vọng rằng thông tin trên đã giúp bạn hiểu rõ hơn về khái niệm và quy trình điện li, cũng như cách phân biệt chất điện li mạnh và chất điện li yếu. Nếu bạn còn bất kỳ câu hỏi nào khác hoặc cần thêm thông tin, hãy tiếp tục đặt câu hỏi. Hamhochoi.net sẽ cố gắng giúp bạn một cách tốt nhất.